原子力システム研究開発事業及び原子力基礎基盤戦略研究イニシアティブ 成果報告会資料集
植物における量子ビーム誘発突然変異の分子機構解明に関する研究
(研究代表者)日出間純 大学院生命科学研究科
(再委託先)独立行政法人農業生物資源研究所、独立行政法人日本原子力研究開発機構
(研究開発期間)平成21年度~23年度
1.研究開発の背景とねらい
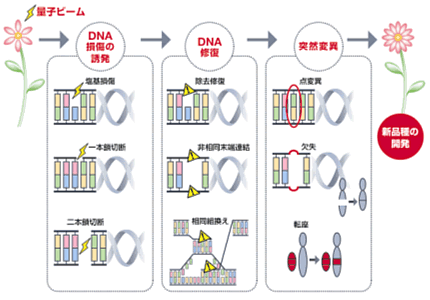
図1 突然変異誘発機構の概略
本事業では、効率的な育種素材創成のため、これまでランダムで偶然と考えられてきた突然変異の誘発に関して、①目的の変異を高頻度で誘発する、②得られる突然変異を制御して、効率的な育種素材を創成する技術開発を目指して、量子ビームにより染色体上のどの部位・箇所に、どのようなDNA損傷が誘発され、またそれらDNA損傷がどのような修復系によって修復され、結果として修復エラーが引き起こされ表現系が変化するのかという点に着目し、変異誘発の分子レベルでの解明に関する解析を実施する(図1参照)。本事業は、幹事機関(受託先)・東北大学と、2つの連携機関(再委託先)・独立行政法人農業生物資源研究所、独立行政法人日本原子力研究開発機構の3研究機関の連携により、3ヶ年計画で実施し、高等植物のイオンビームによる突然変異誘発の分子機構の全容を解明することを目的とする。以下に具体的な各機関の目標を記す。
(1)「DNA損傷と変異スペクトラム、およびクロマチン構造の比較による量子ビーム誘発突然変異機構の解明」(東北大学)
本項目では、植物への量子ビーム照射により、①誘発されるDNA損傷を定量し、②突然変異スペクトラムと比較し、さらに③DNA損傷および突然変異の誘発部位とクロマチン構造との関連を解析することにより、量子ビーム誘発DNA損傷の種類・部位と変異との関連を明らかにする。
(2)「相同組換え、非相同組換えによる複製過程エラーによって生じた変異スペクトラム解明、ならびに新規変異検出システムの開発に関する研究」(独立行政法人農業生物資源研究所)
植物に量子ビームを照射すると、細胞にとって重篤な障害であるDNAの二本鎖切断が生じ、これらは相同組換え(homologous recombination: HR)もしくは非相同組換え(非相同末端結合:non homologous endo joining: NHEJ)によって主として修復されると考えられる。そこで、HR、およびNHEJの変異体を作製し、これら修復系と量子ビームによる変異と関連について解析する。また、ジーンターゲッティング(GT)により改変した除草剤耐性型のアセト乳酸合成酵素(ALS)遺伝子を用いた突然変異解析系の開発を行う。
(3) 「塩基損傷や乗り越え複製によって生じた変異スペクトラムの分子機構の解明に関する研究」(独立行政法人日本原子力研究開発機構)
マーカー遺伝子を導入した突然変異検出系統Arabidopsis/rpsLを用いて、変異誘発が高いと想定される塩基損傷、乗り越え複製と変異との関連について解析する。さらに、突然変異を誘発することが知られているAtREV3遺伝子にアミノ酸置換を導入することにより、突然変異高度誘発遺伝子を作製する。この遺伝子を植物に導入し、突然変異高度誘発株を作出する。
2.研究開発成果
(1)「DNA損傷と変異スペクトラム、およびクロマチン構造の比較による量子ビーム誘発突然変異機構の解明」
①量子ビーム誘発DNA損傷の定量的解析1
既存の高分子DNA傷害解析装置を改良した装置と吸光微量サンプル測定マイクロプレートリーダー装置を用いて、量子ビームによって誘発されることが予想されるDNAの二本鎖切断、一本鎖切断、酸化損傷などの損傷量を定量的に解析するための測定条件を検討した。そして、これらの検討結果を基に、量子ビームを照射した植物試料(発芽7日目のシロイヌナズナにカーボン、ヘリウムイオンビームを照射)中のDNA損傷の定量解析を行った。その結果、一本鎖切断、二本鎖切断に関しては、イオンビーム照射量に応じた損傷量のドースレスポンスカーブを作成することができたが、酸化損傷に関しては、DNAの抽出操作で生じる酸化損傷が多いことが示唆され、DNA抽出条件の更なる検討が必要であることが分かった。現在はDNA抽出条件の検討、および測定法として酸化損傷に対する特異抗体を用いたELISA法による定量解析も同時並行で解析している。
②イオンビームにより生じるDNA欠損箇所の同定
イオンビームによってどの程度の頻度でDNA欠失が引き起こされているのかについて、これまでに独自にイオンビーム(320 MeV, カーボン、80 Gy)を照射し、自殖後代M2を材料に選抜した紫外線耐性1系統、感受性個体1系統の欠損箇所を推測するために、Comparative Genomic Hybridization (アレイCGH)解析を実施した。その結果、耐性1系統、感受性1系統ともに、7番染色体の一部が欠失していることが推定され、さらにPCR法でも確認した。なお、欠失した領域の長さは40 ~50 kb程度であった。本結果は、変異欠失箇所の同定に、CGH解析が極めて有効であることを実証すると共に、イネ乾燥種子に対するカーボンイオンビーム(80 Gy)は、40 kbと比較的大きな欠失を誘発していることを示唆した。
③突然変異誘発部位とクロマチン構造との関連に関する解析
クロマチン構造の違いが、量子ビームによるDNA損傷生成頻度や修復過程に影響を及ぼしているか否かを解析するために、本年度はクロマチン構造状態が異なるヘテロクロマチン(転写が行われていない状態)、ユークロマチン(転写が行われている状態)を分離する方法、条件の検討を行った。具体的には、ヒストンH3の修飾状態が、ヘテロクロマチンとユークロマチンでは異なることを利用して、ヒストンH3に対する抗体を用いた免疫沈降法により行った。その結果、イネをサンプルに、ヘテロクロマチン、ユークロマチンの分離条件を決定した。
(2)「相同組換え、非相同組換えによる複製過程エラーによって生じた変異スペクトラム解明、ならびに新規変異検出システムの開発に関する研究」
①アセト乳酸合成酵素(ALS)遺伝子を用いた突然変異検出系の構築
除草剤抵抗性変異を有するALS遺伝子を利用した突然変異検出系を構築するため、シロイヌナズナALS遺伝子にT-DNAが挿入された変異株(CS877955)の純化を進めた後、CS877955と除草剤抵抗性を有するALS変異体csr1-1及びcsr1-2の交配を行い、後代種子の獲得に成功した。変異検出の予備解析として、野生型シロイヌナズナの葉と根から誘導したカルスを材料にイオンビームに対する感受性を調べた。その結果、シロイヌナズナカルスにおけるイオンビーム感受性試験に関しては、処理を施した線量間でカルスの生育に大きな差異は確認できなかった。よってイオンビームを照射する材料としてシロイヌナズナカルスは突然変異検出には不適であり、生葉を用いることにした。
②相同組換え、非相同組換え機能欠損株の作製
相同組換えと非相同組換え機能と変異誘発との関係を明らかにする目的で、相同組換え、非相同組換え機能(RAD51C、RAD54、Ku80、Lig4)の欠失した植物株を作製した。さらに、突然変異スペクトル解析用のマーカー遺伝子を保持するrip3-3系統との交配を開始した。
③突然変異検出マーカーの変異株への導入
純化が進んだRAD51C、RAD54の欠損変異体に、除草剤抵抗性型ALS遺伝子(csr1-1及びcsr1-2)を交配により導入した。
(3) 「塩基損傷や乗り越え複製によって生じた変異スペクトラムの分子機構の解明に関する研究」
①修復欠損株の作製と至適条件の検討
塩基除去修復遺伝子AtMYH1、ヌクレオチドプール浄化遺伝子AtMTH1、ミスマッチ修復遺伝子AtMSH2、AtPMS1、および損傷乗り越え複製遺伝子AtREV3が欠損した挿シロイヌナズナ系統を入手し、遺伝子座がホモで欠失した系統を選抜した。さらにこれら変異体の量子ビーム感受性を調べた結果、野生型植物よりも量子ビームに対して感受性が高いことがわかった。
②突然変異検出マーカーの変異株への導入
上記の修復欠損株をrip3-3系統と交配し、PCR及び薬剤選抜法でホモ系統を選抜した。さらに、スペクトル解析を行うための至適条件、生育条件の検討を行った結果、生育の遅れや発達異常は見られないことを確認した。
③突然変異高度誘発株の作製
突然変異を誘発することが知られているAtREV3タンパク質の活性中心に位置するロイシンのコドンを、グリシン、アスパラギン、リシン、フェニルアラニン、バリンのそれに置換した遺伝子を作製し、アグロバクテリウムを介してAtREV3欠損植物に導入し、突然変異高度誘発株の候補を得た。
3.今後の展望
本事業の初年度にあたるH21年度は、突然変異誘発の分子機構を解明するために必要不可欠な、①量子ビームによって誘発されるDNA損傷を定量するための装置の改良、定量法の検討(東北大学)、②DNA修復系と突然変異の種類を検討するための突然変異検出植物材料の作製(再委託先:農業生物資源研究所、日本原子力研究開発機構)、③突然変異高頻度誘発株の作製(再委託先・日本原子力研究開発機構)の3点に焦点を絞り解析を進め、業務項目を予定通り実施し、所期の目標を達成した。今後の研究展開、および展望は以下の通りである。
(1)「DNA損傷と変異スペクトラム、およびクロマチン構造の比較による量子ビーム誘発突然変異機構の解明」
① 量子ビーム誘発DNA損傷の定量的解析2:本項目では、今後、イオン種の違い(カーボン、ヘリウム等)や照射量の異なるイオンビーム、ガンマー線によって生じるDNA損傷の定量的比較解析を実施し、量子ビームによって誘発されるDNA損傷の特徴を把握する。本研究成果は、量子ビームによるDNA損傷の特徴を把握することで、変異誘発に関与する修復系との関連が明らかとなる事が期待される。
② イオンビームにより生じるDNA欠損箇所の同定:今後も既に選抜されたイネやシロイヌナズナ変異体を材料に、アレイCGH解析を実施し、イオンビーム誘発変異体の変異、特に大規模な欠失の特徴を調査していく。
③ 突然変異誘発部位とクロマチン構造との関連に関する解析:ヘテロクロマチン、ユークロマチンの分離・単離方法の検討を行い、最終的には、クロマチン構造の違いとDNA損傷生成頻度、変異誘発との関係について比較検討する。本成果は、目的とする遺伝子の変異頻度効率を上げることに繋がることが期待される。
(2)「相同組換え、非相同組換えによる複製エラーによって生じた変異スペクトラム解析、ならびに新規変異検出システムの開発に関する研究」
① アセト乳酸合成酵素(ALS)遺伝子を用いた突然変異検出系の構築
② 相同組換え、非相同組換え機能欠損株の作製
③ 突然変異検出マーカーの変異株への導入
④ 相同組換え、非相同組換え機能欠損株における変異スペクトラム解析
本項目では、H22年度内に、相同組換え、非相同組換え機能欠損株における変異スペクトラム解析を実施するための材料作製を行う。材料は作製され次第、量子ビームを照射し、変異スペクトル解析を実施することで、相同組換え、非相同組換え修復と変異との関係が明らかにできることが期待される。
(3)塩基損傷や乗り越え複製によって生じた変異スペクトラムの分子機構の解明に関する研
① 修復欠損株における突然変異率の解析
② rpsL遺伝子を利用した突然変異スペクトラムの解析
③ 突然変異高度誘発株の作製とその解析
塩基損傷や乗り越え複製によって生じる変異を解析するための材料は順調に整いつつある。今後は、これら変異体を利用して、量子ビームによる突然変異率、変異スペクトラム解析を実施することで、塩基損傷や乗り越え複製による変異誘発との関連が明らかになることが期待される。また、突然変異を高度に誘発することが期待される、DNAポリメラーゼzetaの触媒サブユニットreversionless 3 (AtREV3)改変組換え体は、H22年度内に作製予定である。今後は、AtREV3改変組換え体の突然変異高度誘発に関しての検証を行う。
