原子力システム研究開発事業及び原子力基礎基盤戦略研究イニシアティブ 成果報告会資料集
クリプトビオシスとリンクした放射線耐性機構の解明研究
(研究代表者)奥田隆 昆虫科学研究領域
(再委託先)国立大学法人鹿児島大学
(研究開発期間)平成20年度〜22年度
1.研究開発の背景とねらい
原子力発電を重要なエネルギー供給源としている我が国では、放射線の生体影響は国民の安全・安心を確保するための最重要課題である。また、死因の第一位が“がん”であるわが国では、PET、PETCT等の放射線を用いた高度医療診断および重イオン等の放射線を用いたがん治療が進展しており、放射線生体影響の評価と放射線防護は社会的にも重要であり緊急を要する課題である。従来の放射線生体影響研究は、放射線高感受性に関与する機序解明に対する研究が中心であり、分子生物学的手法を用いて様々な放射線応答因子が明らかにされつつある。しかし、放射線高耐性因子および機序の全容が未だ不明な点が多い。
生物の放射線高耐性の分子機構については、放射線耐性細菌D. radioduransを中心として、特にDNAの修復機構についての詳細な解析が進められてきた。D. radioduransの高い放射線耐性は乾燥に適応して発達したものと考えられており、乾燥耐性と放射線耐性の機構には共通点が多く認められる。多細胞生物にも驚くべき乾燥耐性を持つものがあり、生体内の水分をほぼ完全に失っても生命を維持し、再び吸水すれば活動を再開できる。この生命現象をクリプトビオシスと言い、その能力を持つ生物(ヒルガタワムシ、クマムシ、ブラインシュリンプ等)は放射線に対しても高い耐性を持つことが知られている。例えば、ネムリユスリカの場合、乾燥幼虫にγ線を7,000Gy照射後、水に戻して幼虫は蘇生し(Watanabe et al.,2006a)、重粒子線(ネオン)を200 Gy 照射した場合でも幼虫は蘇生し蛹に変態した(Watanabe et al.,2006b)。実際、ネムリユスリカ幼虫の乾燥(脱水)に伴って放射線耐性が徐々に上昇していく(Nakahara et al., 2008)。しかし、その分子機構についてはほとんど分かっていない。クリプトビオシス動物の中で最も大型のネムリユスリカは、最近、研究代表者によってモデル生物化され、その遺伝子情報も蓄積しつつある。つまり、ネムリユスリカのクリプトビオシスの分子機構を解明することは、放射線耐性の機序を明らかにすることに他ならず、放射線被ばくに対する事前防護策のヒントに繋がるであろう。
2.研究開発成果
クリプトビオシス状態のネムリユスリカは放射線に対して高い耐性を示す。この分子機序を解明するため、乾燥及び放射線ストレスによって誘導される遺伝子を網羅的に調査した。まず乾燥過程の3段階(0h, 12hと36h)でネムリユスリカ幼虫からcDNAが得、ESTデータベースを構築した。その乾燥耐性関連ESTデータベースを解析したところ、全部で15,054クローンが4,807遺伝子クラスターに分類された。その半分は新規遺伝子であると考えられる。ユスリカの特徴として、ヘモグロビンが多く、全遺伝子の7.5%を占めていた。クローン数に基づいた遺伝子の予想発現パターンを調べ、乾燥によって強く誘導され、乾燥耐性に関わっていると思われる遺伝子に注目した。特にシャペロン機能などを持つLEAタンパク質、HSPs、そして酸化ストレス関連遺伝子のグループは乾燥と強く相関を示した。細胞が乾燥する時に最も脅威となるのが活性酸素の発生による生体分子の酸化である。データベース解析によって、ネムリユスリカ幼虫は乾燥の過程で多くの抗酸化因子を合成し、活性酸素の脅威に対抗していることが分かってきた。しかし、予防策を講じているにもかかわらず、クリプトビオシス状態のネムリユスリカ幼虫のDNAは切断されており、蘇生後に修復する必要があることが分かった。このESTデータベースの解析に関する成果はJBC (IF:6.4) に投稿、受理された(Cornette et al., 2010)。ネムリユスリカの高い放射線耐性は、「生体成分の損傷を回避する機構」と「損傷を受けたときの修復機構」によるものと考えられ、それらは乾燥ストレスに適応して発達したものと考えられた。そこで、クリプトビオシス過程でのDNA損傷についてコメットアッセイ法を用いて解析したところ、実際高い頻度でDNA鎖の切断が確認されたが、再水和後にそれらの損傷は修復された(図1)。
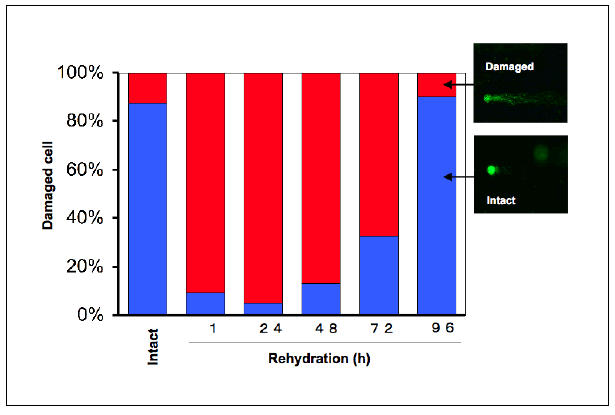
図1 ネムリユスリカのクリプトビオシス(乾燥ストレス)に伴うDNA損傷と修復
定法で乾燥させた幼虫を水に戻し、一定時間後に解剖して脂肪体細胞を摘出した。細胞を固定し、アルカリ条件のコメットアッセイによりDNA損傷を定量した。
次に、乾燥ストレスと放射線ストレスによるDNA損傷規模の解析を行った。活動状態のネムリユスリカ幼虫に50 MeV 4He (LET∞=16.2 keV/㎛) イオンを照射した。線量は半数羽化阻害線量(70 Gy)および半数蛹化阻害線量(160 Gy)とした。ネムリユスリカ幼虫に4Heを照射し、12時間後にコメットアッセイを行ったところ、線量依存的にDNAが損傷していた (図2)。一方、乾燥から蘇生した幼虫のDNAも損傷しており、その程度は70 Gyの4Heを照射した場合と近似していた。いずれの場合も、ほとんどの細胞がDNAに損傷を負っていたにもかかわらず、アポトーシスやネクローシスによる細胞死はわずかしか観察されなかった。放射線照射区および乾燥処理区ともに、48時間目までは損傷DNAの割合に変化はなかったが、96時間目には減少した。
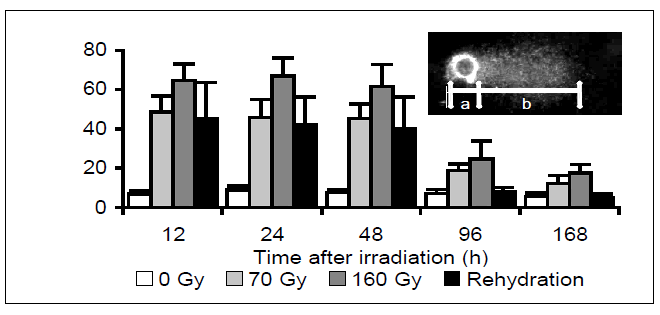
図2 ネムリユスリカの放射線照射後(0-160 Gy)および乾燥から蘇生後(Rehydration)の損傷DNAの量的変化。損傷DNA(%)= b/(a+b)x100
活動状態のネムリユスリカ幼虫に、半数羽化阻害線量(70 Gy)のCo-60ガンマ線と同線量の4Heイオンを照射した。照射した幼虫のRNAからcDNAを合成し、関連遺伝子の発現を定量的PCR法により解析した。比較実験として、クリプトビオシスの誘導から蘇生までの過程について同様の調査を行った。ガンマ線照射によるDNAのダメージは、同線量の4Heイオンを照射した場合に比べて軽微であり、24時間以内に対照区(非照射幼虫)と同レベルにまで回復した。4Heイオンおよびガンマ線を照射したネムリユスリカ幼虫では、そのストレスに応じてDNA修復酵素(Rad23, Rad51)の発現を誘導されていた。一方、4Heイオンでは活性酸素を除去酵素(カタラーゼ、SOD等)の発現は変化が無かったが、ガンマ線照射後3〜12時間にかけて抗酸化酵素の発現が著しく上昇した(図3)。このガンマ線特異的な応答は、抗酸化酵素の発現誘導に活性酸素が介在していることを示唆している。一方、DNA修復に関わるRad23のおよび Rad51の発現はガンマ線と4Heイオン放射線の両方で誘導されたことから抗酸化酵素とは異なる制御系が存在すると考えられた。クリプトビオシス過程でのRad51(相同組換による修復酵素)の発現パターンは、乾燥過程および再水和直後の際にDNA二重鎖の切断が生じている事が示唆された。実際、再水和直後に活性酸素が顕著に発生する事が脂質および DNAの酸化の免疫組織学的解析から証明された。乾燥および放射線ストレス(70 Gy)によるアポトーシスは観察されず、実際アポトーシス誘導に関わる遺伝子の上昇は認められなかった。乾燥および放射線ストレスに伴うDNA損傷及び修復や、それに関わる遺伝子発現パターンの成果は PLoS ONE(IF: 4.3)に投稿し、受理された。
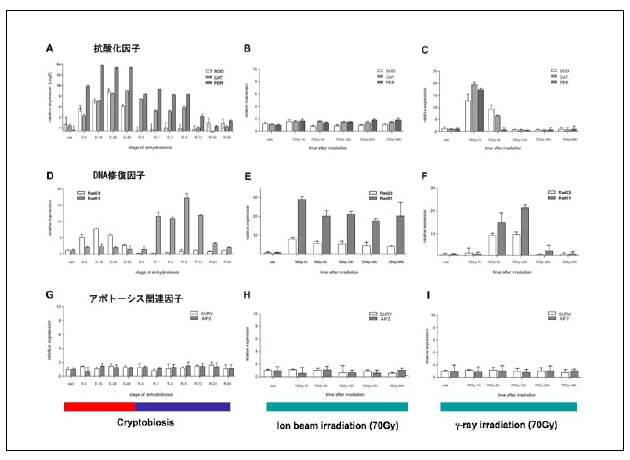
図3 ネムリユスリカの乾燥と放射線ストレスに伴うDNAの損傷と修復に関わる遺伝子の発現パターン A, D, G : クリプトビオシス区、B, E, H : 4Heイオンビーム照射区、C, F, I : γ線照射区
3.今後の展望
ネムリユスリカ水和幼虫にγ-線および4Heイオンビームをさまざまな線量で照射し、RNAを単離して平均化cDNAライブラリーと通常のcDNAライブラリーを新たに構築した。この統合ESTデータベースはハウスキーピング遺伝子のみならず、転写因子やシグナル伝達因子などの比較的発現量の少ない遺伝子が数多く含まれていた。このESTデータベースをもとにDNAチップを作成し、マイクロアレイ解析を進めている。特に抗酸化に関わる分子機序の理解が加速化され、放射線防護に関わる新たな手法の構築に大きな進展が期待される。
4.参考文献
Watanabe et al. (2006a) Int. J. Radiat. Biol. 82: 587.
Watanabe et al. (2006b) Int. J. Radiat. Biol. 82:835.
Nakahara et al., (2008) J. Insect Physiol. 54:1220.
Cornette et al., (2010) JBC 285:35889
Gusev et al., (2010) PLoS ONE (in press)
